Studi clinici osservazionali e interventistici hanno dimostrato che la dieta mediterranea è associata ad un rischio inferiore di eventi cardiovascolari [1, 2]. La dieta mediterranea è ricca di frutta e verdura, ha un basso contenuto di carne e latticini, comprende l’olio extra vergine di oliva (olio EVO) e una piccola quantità di vino [3]. Studi recenti hanno dimostrato che, tra i nutrienti tipici della dieta mediterranea, l’olio EVO possiede effetti benefici, come documentato dalla diminuzione di eventi cardiovascolari in pazienti a rischio di arteriosclerosi trattati con dieta mediterranea con integrazione di olio EVO [1]. La prevenzione del diabete di nuova insorgenza per mezzo dell’olio EVO è stata indicata come un meccanismo che potenzialmente può ritardare la progressione aterosclerotica e le sue conseguenze cliniche. [4]. Sia noi sia altri studiosi, abbiamo recentemente dimostrato che l’olio EVO ha effetti positivi sulla glicemia postprandiale, la quale può avere effetti deleteri sulle malattie vascolari promuovendo e/o aggravando il processo aterosclerotico [5, 6]. Il glucosio postprandiale è stato associato allo stress ossidativo e ad una maggiore incidenza di eventi cardiovascolari in pazienti con e senza diabete [7-9]. L’olio EVO esercita il suo effetto benefico sulla glicemia postprandiale tramite secrezione di insulina mediata da GPL1, un effetto collegato alla riduzione della di-peptidil-peptidasi-4 (DPP-4), un inibitore del glucagon-like peptide-1 (GLP1) [5]. L’effetto benefico sulla glicemia postprandiale è stato attribuito alle sue proprietà antiossidanti e sembrerebbe attribuibile proprio all’olio EVO, in quanto l’integrazione del pasto con olio di mais non ha determinato cambiamenti sulla glicemia postprandiale [5]. Questo studio suggerisce che specifici componenti dell’olio EVO incidono sulla glicemia postprandiale; la nostra attenzione si è focalizzata sull’oleuropeina, uno dei componenti attivi più comuni nelle foglie di ulivo, e consiste in idrossitirosolo (3,4’-diidrossifeniletanolo, HT), acido elenolico e glucosio. L’oleuropeina possiede proprietà antiossidanti [10, 11], che potrebbero essere implicate nel miglioramento della glicemia postprandiale con olio EVO, tuttavia non sono ancora presenti dati in soggetti umani [5]. Pertanto, abbiamo intrapreso uno studio interventistico per analizzare gli effetti dell’oleuropeina sulla glicemia postprandiale e lo stress ossidativo da Nox2 in soggetti sani.
Metodi
Popolazione studiata e reclutamento
Venti soggetti sani (10 uomini e 10 donne, età 33,9 ± 6,9 anni) hanno dato il consenso informato a partecipare allo studio interventistico, eseguito tra luglio e settembre 2016 al Policlinico Umberto I – Roma. Le caratteristiche cliniche e demografiche dei soggetti sani, così come i nutrienti del pasto, sono riportati rispettivamente nelle tabelle 1 e 2.
Impostazione dello studio
Lo studio è di tipo incrociato, casuale, a doppio-cieco e placebo-controllato (figura 1). I partecipanti, casualmente selezionati, ricevevano 20 mg di oleuropeina o 20 mg di placebo immediatamente prima del pranzo. La selezione è stata effettuata tramite procedura basata su una sequenza numerica casuale. Le capsule placebo e le capsule attive erano identiche nell’aspetto ed entrambe inodore. Il controllo qualità su entrambe le capsule ha confermato la loro sicurezza. Nessuno dei partecipanti assumeva integratori vitaminici o antiossidanti, statina, o farmaci antiaggreganti piastrinici nel mese precedente l’inizio dello studio. Altri criteri di esclusione sono stati: i) presenza di tumori maligni, ii) presenza di malattie infiammatorie croniche, iii) assunzione di alcolici, iv) tabagismo, v) gravidanza o allattamento, vi) età <18 anni. Dopo una fase di washout della durata di 10 giorni, i due gruppi si sono incrociati per ricevere il trattamento opposto.
| Variabili |
| Età (anni) 33.9 ± 6.9 |
| Uomini, n (%) 10 (50) |
| Indice di massa corporea (kg m-2) 20.7 ± 3.7 |
| PS sistolica (mmHg) 124 ± 5.0 |
| PS diastolica (mmHg) 72 ± 7.4 |
| Colesterolo totale (mg dl–1) 171 ± 13.3 |
| Lipoproteine a bassa densità (mg dl–1) 81 ± 11.3 |
| Glicemia a digiuno (mg dl–1) |
I partecipanti sono stati valutati al tempo zero (T0) e 2 ore dopo il pranzo (T120) analizzando il loro profilo glicemico che includeva glucosio, insulina, attività DPP-4 e GLP-1, e stress ossidativo – comprendente l’attività peptidica solubile derivata dalla NADPH ossidasi (sNox2-dp), 8-iso-prostaglandina (PGF) 2α e fosforilazione piastrinica p47phox. Ogni determinazione del sangue è stata eseguita alla cieca. Lo studio è conforme alla dichiarazione di Helsinki e approvato dal Comitato Etico dell’Università La Sapienza di Roma (No. 509/16).
Livelli sierici di Nox2
I livelli sierici del peptide derivato solubile (sNOX2-dp) sono stati misurati con metodo ELISA (saggio immuno-assorbente legato ad un enzima), variato rispetto a quanto riportato in passato [12]. Il saggio si è basato su: 1) soluzioni a concentrazione nota di Nox2-dp e campioni di siero (1 μg di proteina) in piastra ELISA a 96 pozzetti per una notte a 4°C; 2) lavaggio dei materiali non legati al campione; 3) aggiunta in ogni pozzetto di perossidasi di rafano anti-sNox2-dp, anticorpo monoclonale contro la sequenza amminoacidica (224-268) della porzione di membrana extracellulare di Nox2; e 4) quantificazione dei coniugati enzimatici anticorpali immobilizzati, monitorando l’attività del perossidasi di rafano in presenza del substrato 3,3’,5,5’-tetrametilbenzidina. L’attività enzimatica è misurata spettrofotometricamente dall’incremento dell’assorbimento a 450 nm dopo l’acidificazione dei prodotti formati (acido solforico 2 mol l-1). Poiché l’incremento in assorbimento è direttamente proporzionale alla quantità di sNox2-dp del campione sconosciuto, quest’ultimo può essere ricavato per interpolazione da una curva di riferimento generata nello stesso saggio con standard di riferimento a concentrazione nota di sNox2-dp (0-200 pg ml-1). I valori sono espressi in pg ml-1; i coefficienti di variazione intrasaggio e intersaggio sono stati <10%.
Saggi 8-Iso-PGF2α
Gli isoprostani nel siero e nelle piastrine (8-iso-PGF2α-III) sono stati misurati con il metodo dell’immunodosaggio enzimatico (DRG International) e sono espressi in pmol l-1. I coefficienti di variazione intrasaggio e intersaggio sono stati <10%.
Concentrazione di glucosio e insulina nel siero
Glucosio e insulina sono stai misurati in campioni di siero utilizzando il kit commerciale ELISA (rispettivamente Arbor Assay e DRG International). I valori di glucosio sono espressi in mg dl-1 e i valori di insulina in μIU ml–1.
Concentrazione di GLP1 nel siero
Il kit commerciale ELISA (DRG International) è stato utilizzato per la determinazione quantitativa dei livelli di GLP1 bioattivo (7-36) e (9-36) nel siero. I valori di GLP1 sono espressi in pmol l-1.
Attività DPP-4
L’attività DPP-4 è stata valutata in campioni di siero con saggi commerciali (Sigma Aldrich). In questo saggio, DPP-4 scinde un substrato non fluorescente, H-Gly-Pro-AMC, per rilasciare un prodotto fluorescente, 7-amino-4-methyl cumarina. L’attività DDP-4 è espressa in μU ml–1, dove un’unità DPP-4 rappresenta la quantità di enzima che idrolizzerà il substrato di DPP-4 per produrre 1,0 μmole di 7-amino-4-methyl cumarina al minuto, a 37°C.
Analisi HPLC dei livelli di HT nel plasma
Delle soluzioni madre di HT sono state preparate ad una concentrazione di 1 mg ml-1 in acqua Milli-Q e diluite a 100 μg ml-1 per soluzione di lavoro. Una soluzione di 3-(4- idrossifenil)-propanolo usato come standard interno (ISTD) è stata preparata e diluita a 150 μg ml–1.Le soluzioni standard sono state preparate in fase mobile nell’intervallo 10 – 1000 ng ml-1 e lo standard interno è stato addizionato per ottenere una concentrazione costante di 100 ng ml-1.
Prima dell’analisi, i campioni sono stati soggetti a trattamento con β-glucuronidasi (un enzima che ha attività di sulfuronidase) in modo da scindere il glucuronide e i solfati attivi.
L’acetato di sodio (500 μl) e il β-glucuronidasi (12,5 μl) sono stati aggiunti a 500 μl di campioni di plasma e incubati per 1 ora a 37°C. Dopo l’incubazione, i campioni sono stati estratti con acetonitrile-etilacetato (1:3) e le provette miscelate a 100 cicli min-1 per 30 minuti e centrifugate per 5 minuti a 300 g. Lo strato superiore è stato rimosso e lasciato evaporare a secchezza. Il residuo è stato dissolto in 500 μl di fase mobile e 25 μl sono stati iniettati nella colonna e analizzati usando Agilent 1200 Serie Infinty, un sistema di cromatografia ad alte prestazioni dotato di una colonna a fase inversa Eclipse Plus C18 (4.6 × 100 mm, 5 μm) con rivelatore UV visibile a serie di diodi. La fase mobile con una portata di 1,2 ml min-1 consisteva in acqua acetonitrile-Milli-Q (incluso il 2% di acido acetico; 15:85, v/v) e pH regolato a 1,97 con 5,0 mol l-1 di acido cloridrico.
I cromatogrammi sono stati ottenuti secondo il tempo di ritenzione con rilevamento a 280 nm, in cui l’assorbanza dell’HT è massima. L’identificazione del picco di questo composto è stato effettuato confrontando il tempo di ritenzione e i suoi spettri UV (da 200 a 400 nm) con quelli di uno standard.
Studio in vitro
Sono stati prelevati, tra le 8:00 e le 9:00, campioni di sangue trattato poi con citrato di sodio, da soggetti sani a digiuno da almeno 12 ore. Per ottenere plasma ricco di piastrine (PRP) i campioni di sangue citrato sono stati centrifugati per 15 minuti a 180 g. Per evitare la contaminazione dei leucociti, solamente il 75% superiore del PRP è stato prelevato come descritto da Pignatelli et al. [11]. Prima dell’attivazione, i campioni di PRP sono stati incubati (20 minuti a 37°C) con dosi scalari di HT (0,25, 0,5, 1 μg ml–1). Dopo l’incubazione, i campioni sono stati trattati con acido arachidonico (AA, 0,5 mmol l–1; Sigma Aldrich) per 10 minuti a 37°C. I supernatanti e i pellet sono stati conservati a -80°C per l’analisi della fosforilazione p47phox e degli isoprostani.
Analisi Western blot della fosforilazione p47phox
La fosforilazione p47phox è stata analizzata in piastrine preparate come da precedente descrizione [13]. Pellet di piastrine sono stati sospesi in un 2x tampone di lisi (5 mmol l–1 EDTA, 0,15 mol NaCl, 0,1 mol Tris pH 8,0, 1% tritone e 10 μg ml–1 di un cocktail inibitore di proteasi e fosfatasi). Quantità uguali di proteine (30 μg per corsia) stimate con saggio proteico di Bradford, sono state solubilizzate in un 2x tampone di campionamento Laemmli contenente 20% di 2-mercaptoetanolo. Le proteine sono state separate tramite elettroforesi su gel di poliacrilammide in presenza di sodio dodecil solfato-10% e successivamente elettrotrasferite alle membrane di nitrocellulosa. Dopo il blocking, le membrane contenenti fosfoserina sono state incubate con anticorpi policlonali di coniglio anti p47phox (Abcam, Cambridge, UK) o anticorpi monoclonali di topo anti-β-actina (Santa Cruz Biotechnology, Dallas, TX, USA) e mantenuti per una notte a 4°C. Le membrane sono state poi incubate con anticorpi secondari (Santa Cruz Biotechnology; 1:5000) e i complessi immunitari sono stati rilevati dal substrato di chemiluminescenza potenziato. L’analisi densitometrica delle bande è stata eseguita utilizzando il software Image J.
Dimensione del campione
Il numero minimo di partecipanti da includere in questo studio incrociato è stato calcolato tenendo in considerazione i seguenti fattori: 1) differenze rilevanti di livelli postprandiali di sNOX2-dp tra i due gruppi (trattati con oleuropeina vs. placebo; dopo 120 minuti) ≥12 pg ml–1; 2) deviazioni standard (SDs) omogenee tra i gruppi (=11) e 3) probabilità di errore tipo I α = 0,05 e potenza 1 – β = 0,90. La dimensione minima del campione per questo studio incrociato è stato di 20 soggetti.
Metodi statistici
Variabili categoriche (come il sesso) sono riportate come valori percentuali e variabili continue come media ± deviazione standard salvo diversamente indicato. L’indipendenza delle variabili categoriche è stata testata con il test del Chi-quadrato. I confronti tra i gruppi sono stati eseguiti con il test della t di Student e sono stati ripetuti come è indicato procedere con i test non parametrici (test (z) di Kolmogorov-Smirnov in caso di varianze non omogenee, verificate dal test di Levene). I dati dello studio incrociato sono stati analizzati per la valutazione dell’effetto trattamento e di periodo, con un’analisi split-plot ANOVA con un fattore tra i soggetti between-subject (sequenza di trattamento) e due fattori entro i soggetti within-subject (pre vs post trattamento). L’analisi è stata eseguita separatamente, per confrontare un pasto con e senza oleuropeina. I risultati sono espressi come medie ± DS. L’analisi bivariata è stata eseguita con il test di correlazione per ranghi di Spearman. Un valore di P < 0,05 è stato considerato statisticamente significativo. Tutte le analisi sono state eseguite con software SPSS V.18.0 (SPSS Statistics v. 18.0, SPSS Inc., Chicago, IL, USA).
Risultati
Stress ossidativo postprandiale
Le caratteristiche cliniche della popolazione sono riportate nella Tabella 1.
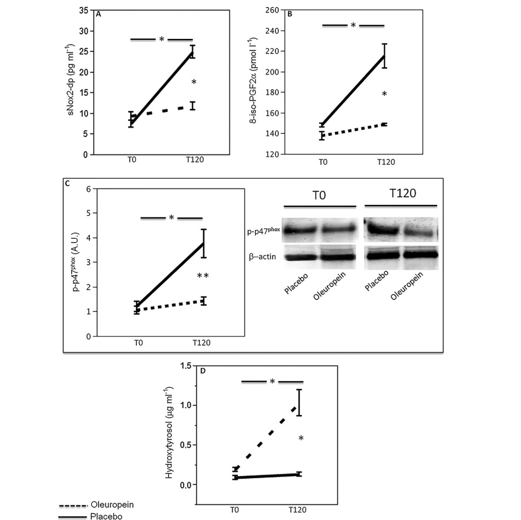
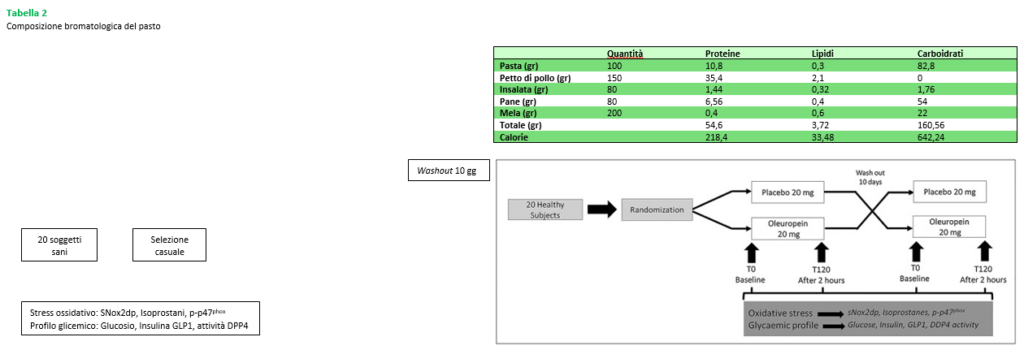
Figura 2
Effetto dell’oleuropeina su biomarker dello stress ossidativo. sNox2-dp (n = 20; A), 8-iso-PGF2a (n = 20; B), fosforilazione piastrinica p47phox (n = 5) densitometria con banda rappresentativa Western blot (C) e concentrazione di idrossitirosolo (D) all’inizio (T0) e 2 ore dopo il pasto (T120) in soggetti sani con integrazione di 20mg di oleuropeina (linea nera tratteggiata) o 20mg di placebo (linea nera; *P < 0,001; **P < 0,05)
Le variabili base dei due gruppi erano simili (Figura 2 Pannelli A-C).
Una differenza significativa tra i trattamenti (oleuropeina vs placebo) è stata riscontrata rispetto al sNox2-dp (F = 38, P < 0,001; Figura 2A), 8-iso-PGF2α (F = 19, P < 0,001; Figura 2B), fosforilazione piastrinica p47phox (F = 12, P = 0,001; Figura 2C) e HT (F = 24, P < 0,001) dall’ANOVA effettuata sui dati dello studio incrociato. I dati adattati con ipotesi di sfericità sono riportati nella Tabella S1.
Rispetto al punto di partenza (T0), i soggetti trattati con placebo hanno mostrato un aumento di sNox2-dp (226%), 8-iso-PGF2α (45%) e fosforilazione piastrinica p47phox (212%; Figura 2A–C). Viceversa, rispetto al T0, i soggetti trattati con oleuropeina hanno mostrato un minore aumento di sNox2-dp (25%), 8-iso-PGF2α (8%) e fosforilazione piastrinica p47phox (42%; Figura 2A–C). Il plasma HT al T0 era 0,12 ± 0,02 μg ml–1 ed è aumentato a 1,05 ± 0,52 μg ml–1 in soggetti trattati con oleuropeina; diversamente, non sono stati registrati cambiamenti nei soggetti trattati con placebo (Figura 2D).
Profilo glicemico postprandiale
Le variabili sanguigne al punto di partenza sono risultate simili nei due gruppi (Figura 3). Dall’ANOVA eseguita sui dati dello studio incrociato, è stata riscontrata una differenza significativa tra il pasto con oleuropeina e il pasto con placebo, rispetto al glucosio (F = 5,8, P = 0,02; Figura 3A), all’insulina (F = 7,3, P = 0,01; Figura 3B), al GLP1 (F = 62, P < 0,001; Figura 3C) e all’attività DPP-4 (F = 16, P < 0,001; Figura 3D). I dati adattati con ipotesi di sfericità sono riportati nella Tabella S1. Rispetto al T0, i soggetti trattati con placebo hanno mostrato livelli maggiori di glucosio (16%) e insulina (61%; Figura 3 A e B); viceversa, rispetto al T0, sono stati osservati incrementi inferiori di glucosio nel sangue (2%) e un incremento più evidente di insulina nel sangue (116%) (Figura 3 A e B) nei soggetti trattati con oleuropeina.
Rispetto al T0, il GLP1 è aumentato in maniera significativa nei soggetti trattati con oleuropeina (19%) ma è rimasto invariato dopo il placebo (-1%). Inoltre, l’attività DPP-4 ha mostrato un notevole incremento nei soggetti trattati con placebo (150%) e un incremento inferiore nei soggetti trattati con oleuropeina (35%; Figura 3 C, D).
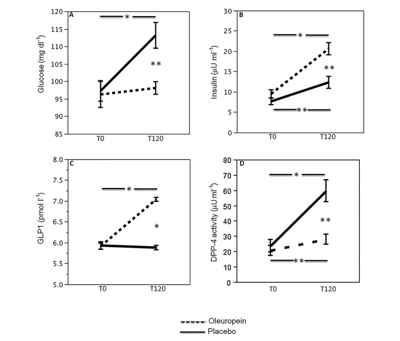
Figura 3
Effetto dell’oleuropeina sul profilo glicemico. Glucosio nel sangue (A), insulina (B), GLP1 (C), attività DPP-4 (D) prima (T0) e 2 ore dopo (T120) il pasto in soggetti sani (n=20) con integrazione di 20mg di oleuropeina (linea nera tratteggiata) o 20mg di placebo (linea nera; *P < 0,001; **P < 0,05)
Il cambiamento (Δ; espresso da valori differenti tra prima e dopo il trattamento) del GLP1 è correlato con Δ dell’attività DPP-4 [Spearman’s rho (Rs): –0,558; P < 0,001] e Δ insulina (Rs: 0,330; P < 0,05). Δ dell’attività DPP-4 è correlato con Δ sNox2-dp (Rs: 0,615; P < 0,001), Δ 8-iso-PGF2α (Rs: 0,33; P < 0,05) e Δ fosforilazione piastrinica p47phox (Rs: 0,435; P < 0,05).
Studio in vitro
Le piastrine di volontari sani (n=3, due uomini, una donna età 41,3 ± 9,0 anni) sono state incubate con concentrazioni scalari di HT (0,25–1 μg ml–1). Queste dosi sono state mantenute nello stesso intervallo delle concentrazioni di HT nel sangue rilevate in circolazione dopo la somministrazione di oleuropeina. Le piastrine trattate con HT stimolate con collagene hanno mostrato un calo dipendente dalla dose di fosforilazione p47phox e di produzione di 8-iso-PGF2α rispetto alle piastrine non trattate (Figura 4).
Discussione
Lo studio fornisce prova che l’oleuropeina, un componente dell’olio EVO, diminuisce la glicemia postprandiale con un meccanismo mediato da Nox2.
Un numero crescente di prove suggerisce che la fase postprandiale è associata con la repentina formazione di specie reattive ossidanti (ROS), che sono implicate nell’infiammazione sistemica, nella disfunzione endoteliale ed infine nella malattia cardiovascolare [14, 15]. L’analisi dell’attività Nox2, tra i più importanti produttori di cellule ROS [16], ci ha permesso di dimostrare che la formazione postprandiale di ROS era attribuibile all’attivazione del Nox2 e che 10 gr di olio EVO neutralizzavano questo fenomeno regolando l’attivazione del Nox2; questo effetto sembrerebbe attribuibile a componenti specifici dell’olio EVO, poiché l’olio di mais non è stato utile ai fini della protezione dallo stress ossidativo postprandiale [15].
L’olio EVO è una fonte di vari componenti fenolici, come il tirosolo, l’HT e l’oleuropeina [17-20]. Questo fenolo complesso esercita diversi effetti biologici; in particolare, è stato riscontrato che l’oleuropeina è un potente spazzino di radicali liberi dell’ossigeno [11] e specie nitrogene [21] e inibisce l’ossidazione delle lipoproteine a bassa densità [22]. L’oleuropeina viene idrolizzata in HT nel sistema digerente, che viene poi assorbito nel flusso sanguigno. L’oleuropeina è stata identificata come il precursore più idoneo dell’HT per l’incorporazione negli alimenti, grazie alla sua migliore stabilità durante la digestione e conseguentemente una più alta biodisponibilità [23]. Secondo Servili et al. [24], 10 gr di denocciolatura di olive fresche contengono circa 20 mg di oleuropeina; tale quantità è stata dunque somministrata a soggetti sani, per stabilire se fosse responsabile per le proprietà glicemiche e antiossidanti dell’olio EVO. In particolare, abbiamo dimostrato che 20 mg di oleuropeina sottoregolano l’attivazione del Nox2-dp e la fosforilazione piastrinica p47phox (la subunità citosolica dell’Nox2 che attiva il sito catalitico dopo la traslocazione della membrana cellulare) [3]; per di più, la riduzione dello stress ossidativo è stata convalidata da una minor produzione di 8-iso-PGF2α. La formazione di ROS durante la fase postprandiale può avere potenziali effetti deleteri sul metabolismo glicemico poiché il ROS interferisce con la produzione di incretine da parte del tratto gastrointestinale. Le incretine GLP1 e GIP vengono secrete dall’intestino tenue distale in risposta alla stimolazione dei suoi recettori nel pancreas endocrino, quindi richiamando la secrezione di insulina e abbassando il livello di glucosio postprandiale nel sangue [24].
Figura 4
Studio in vitro. La densometria della fosforilazione piastrinica p47phox con una banda rappresentativa Western blot (A) e la produzione 8-iso-PGF2α (B) sono state valutate in piastrine incubate con dosi scalari di idrossitirosolo (HT, 0.25–1 μg ml–1) e stimolate con acido arachidonico (AA, 0,5 mmol l–1; n = 3, *P < 0,05)
I ROS sono regolatori importanti di questo fenomeno in quanto attivatori della DPP-4, che rapidamente disattiva l’attività delle incretine impedendo così la secrezione di insulina [25, 26]. L’integrazione di 10 gr di olio EVO nel pasto ha avuto effetti positivi sul profilo glicemico postprandiale, poiché era associato con un incremento delle incretine in combinazione con un decremento dell’attività DPP-4; questo suggerisce che l’olio EVO è responsabile di una migliore glicemia postprandiale attraverso un meccanismo di mediazione dello stress ossidativo e successivamente di una sovraregolazione delle incretine [5]. Basandoci su questo abbiamo indagato se l’oleuropeina condivideva effetti simili sulle incretine e quindi sul profilo glicemico. Per affrontare questo tema, abbiamo paragonato gli effetti di 20 mg di oleuropeina vs. placebo sul profilo glicemico postprandiale di soggetti sani e abbiamo documentato che il trattamento con l’oleuropeina era associato con una riduzione media di glucosio di 14 mg dl-1. Poiché questo effetto coincideva con un significativo aumento di insulina, abbiamo ipotizzato che l’oleuropeina fosse responsabile della sovraregolazione delle incretine. In relazione a questo, l’attività del GLP1 nel sangue è incrementata a seguito del trattamento con oleuropeina, mentre l’attività DPP-4 è diminuita, suggerendo che l’oleuropeina possa comportarsi come un inibitore del DPP4 riducendo lo stress ossidativo da Nox2. Per indagare sull’effetto antiossidante osservato dopo la somministrazione di oleuropeina, abbiamo misurato i livelli di HT, una conseguenza della biotrasformazione dell’oleuropeina nel corpo umano con attività anti radicali liberi [27]. Abbiamo quindi effettuato degli studi in vitro utilizzando le piastrine come fonte cellulare di ROS derivato da Nox2 e dimostrato che le piastrine trattate con HT e stimolate con collagene hanno impedito lo stress ossidativo da Nox2, come documentato da una minore fosforilazione p47phox e produzione di isoprostano. Lo studio ha i suoi risvolti e le sue limitazioni. Il fatto che l’oleuropeina riduce la glicemia postprandiale ha consentito ulteriori approfondimenti negli effetti antidiabetici dell’olio EVO, già noto per la riduzione del rischio del diabete di nuova insorgenza [1]. Lo studio è stato effettuato su soggetti sani e giustifica ulteriori ricerche su soggetti diabetici; è limitato per l’approccio metodologico, che preclude analisi sull’efficacia dell’oleuropeina a lungo termine.
In conclusione, l’oleuropeina, un componente dell’olio EVO, migliora la glicemia postprandiale in soggetti sani grazie ad un meccanismo di mediazione dello stress ossidativo. Questo rapporto preliminare giustifica ulteriori ricerche per verificare se l’oleuropeina possa essere un nuovo candidato al miglioramento del profilo glicemico in pazienti affetti da diabete mellito.
Interessi concorrenti
Non ci sono interessi concorrenti da dichiarare.
Collaboratori
R.C. e F.V. hanno progettato la ricerca, analizzato i dati, effettuato revisioni critiche del manoscritto per contenuti intellettuali e redatto il manoscritto; R.S. ha fornito la materia prima per la preparazione delle capsule; L.L. ha effettuato l’analisi statistica; C.N., V.Cam., V.Cas., M.N. e S.B. hanno raccolto i campioni ed effettuati gli esperimenti; tutti gli autori hanno letto e approvato il manoscritto finale.
_____________________________________
Contatti Prof. Francesco Violi, I Clinica Medica, Dipartimento di Medicina Interna e Specialità Mediche,
Roberto Carnevale1, Romano Silvestri2, Lorenzo Loffredo3, Marta Novo3, Vittoria Cammisotto3, Valentina Castellani3, Simona Bartimoccia3, Cristina Nocella1 e Francesco Violi3
1Dipartimento di Scienze Medico Chirurgiche e Biotecnologie, Sapienza Università di Roma, Latina, Italia, 2Dipartimento di Chimica e Tecnologie dei Farmaci, Sapienza Università di Roma, Roma, Italia, e 3Dipartimento di Medicina Interna e Specialità Mediche, Sapienza Università di Roma, Roma, Italia
OBIETTIVI
L’olio extra vergine di oliva abbassa la glicemia postprandiale. Abbiamo studiato la capacità dell’oleuropeina, un componente dell’olio extra vergine d’oliva, di esercitare un effetto simile sulla glicemia postprandiale e il relativo meccanismo sottostante.
METODI
Venti soggetti sani sono stati inseriti casualmente in uno studio incrociato e trattati con 20 mg di oleuropeina o placebo, somministrati immediatamente prima del pranzo. Due ore prima del pasto e due ore dopo sono stati analizzati la glicemia postprandiale, l’insulina nel sangue, la di-peptidil-peptidasi-4 (DPP-4), il glucagon-like peptide-1 (GLP1) e lo stress ossidativo – che comprende l’attività peptidica solubile derivata dalla NADPH ossidasi (sNox2-dp), 8-iso-prostaglandina-2α e fosforilazione piastrinica p47phox.
RISULTATI
Dopo due ore, i soggetti trattati con oleuropeina presentavano livelli di glucosio nel sangue sensibilmente inferiori, attività ridotta della DPP-4, maggiori livelli di insulina e glucagon-like peptide-1 rispetto ai soggetti trattati con placebo; così come ridotti livelli di sNox2-dp, 8-iso-PGF2α e fosforilazione piastrinica p47phox. L’attività DPP-4 è in forte correlazione con sNox2-dp [Spearman’s rho (Rs) = 0.615; P< 0.001], fosforilazione piastrinica p47phox (Rs = 0.435; P< 0.05) e 8-iso-prostaglandine-2α (Rs = 0.33; P < 0.05). Lo studio in vitro ha dimostrato che l’idrossitirosolo, un metabolite dell’oleuropeina, riduce sensibilmente la fosforilazione piastrinica p47phox e la formazione di isoprostano.
CONCLUSIONI
I risultati indicano che l’oleuropeina migliora il profilo glicemico postprandiale ostacolando lo stress ossidativo da Nox2.
CIÒ CHE GIÀ SAPPIAMO SULL’ARGOMENTO
• È noto che la fase postprandiale è associata ad una formazione repentina di specie reattive ossidanti e ad un aumento del profilo glicemico.
• L’olio Extravergine di oliva (olio EVO) esercita un effetto positivo sulla glicemia postprandiale e sullo stress ossidativo grazie alle sue proprietà antiossidanti.
• L’oleuropeina ha proprietà antiossidanti, che possono essere impiegate per migliorare la glicemia postprandiale e lo stress ossidativo.
COSA AGGIUNGE LO STUDIO
• L’oleuropeina, un componente dell’olio extra vergine d’oliva, migliora la glicemia postprandiale riducendo il glucosio e incrementando l’insulina e l’attività di-peptidil-peptidasi-4 in soggetti sani.
• L’oleuropeina, migliora lo stress ossidativo postprandiale riducendo l’attività di Nox2 in soggetti sani.
• L’oleuropeina potrebbe essere il nuovo candidato al miglioramento del profilo glicemico in pazienti con diabete mellito.
Leggi anche:




